Антителата, наричани още имуноглобулини (Ig), са гликопротеини, които специфично се свързват с антигени.
Конвенционалните препарати за антитела се произвеждат чрез имунизиране на животни и събиране на антисерум.Следователно антисерумът обикновено съдържа антитела срещу други несвързани антигени и други протеинови компоненти в серума.Общите антигенни молекули съдържат предимно множество различни епитопи, така че конвенционалните антитела също са смес от антитела срещу множество различни епитопи.Дори конвенционалните серумни антитела, насочени срещу един и същ епитоп, все още са съставени от хетерогенни антитела, произведени от различни В клетъчни клонове.Следователно конвенционалните серумни антитела се наричат още поликлонални антитела или накратко поликлонални антитела.
Моноклоналното антитяло (моноклонално антитяло) е силно еднородно антитяло, произведено от единичен В клетъчен клонинг и насочено само срещу специфичен епитоп.Обикновено се приготвя чрез хибридомна технология – технологията за хибридомни антитела се основава на технология за клетъчно сливане, съчетаваща В-клетки със способността да отделят специфични антитела и миеломни клетки с безкраен капацитет на растеж в В-клетъчни хибридоми.Тази хибридомна клетка има характеристиките на родителска клетка.Той може да пролиферира неограничено и безсмъртно in vitro като миеломни клетки и може да синтезира и отделя специфични антитела като лимфоцити от далака.Чрез клониране може да се получи моноклонална линия, получена от единична хибридомна клетка, тоест хибридомна клетъчна линия.Антителата, които произвежда, са силно хомогенни антитела срещу една и съща антигенна детерминанта, тоест моноклонални антитела.
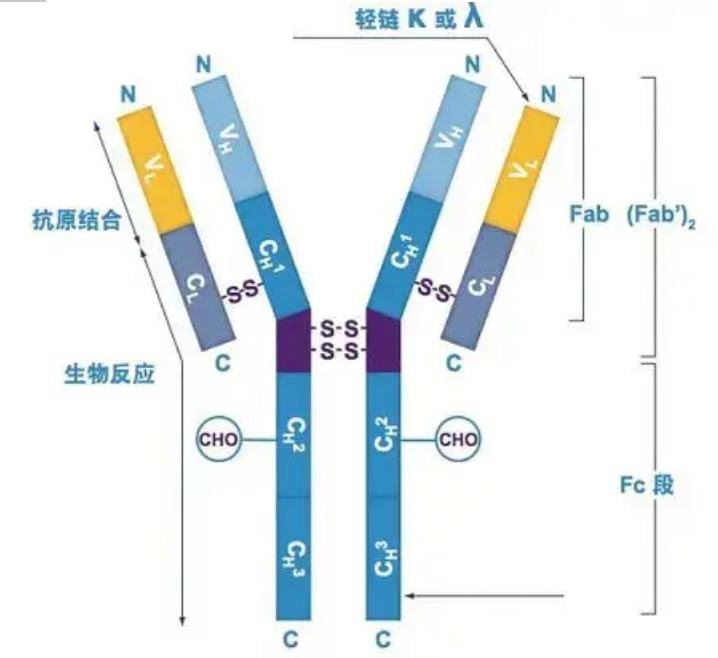
Антителата съществуват като един или повече Y-образни мономери (т.е. моноклонални антитела или поликлонални антитела).Всеки Y-образен мономер е съставен от 4 полипептидни вериги, включително две идентични тежки вериги и две идентични леки вериги.Леката верига и тежката верига се наименуват според тяхното молекулно тегло.Върхът на Y-образната структура е вариабилният регион, който е мястото за свързване на антигена.(Извадка от Detai Bio-Monoclonal Antibody Concept)
Структура на антитялото
 Тежка верига
Тежка верига
Има пет вида тежки вериги на Ig от бозайници, наречени с гръцките букви α, δ, ε, γ и μ.Съответните антитела се наричат IgA, IgD, IgE, IgG и IgM.Различните тежки вериги се различават по размер и състав.α и γ съдържат приблизително 450 аминокиселини, докато μ и ε съдържат приблизително 550 аминокиселини.
Всяка тежка верига има два региона: постоянен регион и променлив регион.Всички антитела от един и същи тип имат една и съща постоянна област, но има разлики между антителата от различни видове.Постоянните региони на тежките вериги γ, α и δ са съставени от три Ig домена в тандем, с шарнирен регион за увеличаване на неговата гъвкавост;постоянните региони на тежките вериги μ и ε са съставени от 4 Ig домена.Вариабилният регион на тежката верига на антитялото, продуциран от различни В клетки, е различен, но променливият регион на антитялото, продуциран от една и съща В клетка или клетъчен клон, е един и същ и променливият регион на всяка тежка верига е с дължина около 110 аминокиселини., и образуват единичен Ig домейн.
Лека верига
При бозайниците има само два вида леки вериги: тип ламбда и тип капа.Всяка лека верига има два свързани домена: постоянен регион и променлив регион.Дължината на леката верига е около 211~217 аминокиселини.Двете леки вериги, съдържащи се във всяко антитяло, винаги са еднакви.При бозайниците леката верига във всяко антитяло има само един тип: капа или ламбда.При някои по-ниски гръбначни, като хрущялни риби (хрущялни риби) и костни риби, се срещат и други видове леки вериги като типа йота (йота).
Fab и Fc сегменти
Fc сегментът може директно да се комбинира с ензими или флуоресцентни багрила за маркиране на антитела.Това е частта, в която антитялото се занитва върху плаката по време на процеса ELISA и също така е частта, в която второто антитяло се разпознава и свързва при имунопреципитация, имуноблотинг и имунохистохимия.Антителата могат да бъдат хидролизирани в два F(ab) сегмента и един Fc сегмент чрез протеолитични ензими като папаин, или могат да бъдат разбити от шарнирната област чрез пепсин и хидролизирани в един F(ab)2 сегмент и един Fc сегмент.Фрагментите на IgG антитела понякога са много полезни.Поради липсата на Fc сегмент, F(ab) сегментът няма да се утаи с антигена, нито ще бъде уловен от имунните клетки при in vivo изследвания.Поради малките молекулни фрагменти и липсата на омрежваща функция (поради липсата на Fc сегмент), Fab сегментът обикновено се използва за радиомаркиране във функционални изследвания, а Fc сегментът се използва главно като блокиращ агент при хистохимично оцветяване.
Променливи и постоянни региони
Вариабилният регион (V регион) е разположен на 1/5 или 1/4 (съдържащ около 118 аминокиселинни остатъка) от Н веригата близо до N-края и 1/2 (съдържащ около 108-111 аминокиселинни остатъка) близо до N-края на L веригата.Всеки V регион има пептиден пръстен, образуван от вътреверижни дисулфидни връзки и всеки пептиден пръстен съдържа приблизително 67 до 75 аминокиселинни остатъка.Съставът и разположението на аминокиселините във V областта определят антиген-свързващата специфичност на антитялото.Поради непрекъснато променящите се типове и последователност на аминокиселините във V областта, могат да се образуват много видове антитела с различна специфичност на свързване на антиген.V регионите на L веригата и Н веригата се наричат съответно VL и VH.В VL и VH аминокиселинният състав и последователността на някои локални региони имат по-висока степен на вариация.Тези региони се наричат хиперпроменливи региони (HVR).Аминокиселинният състав и разположението на не-HVR частите във V региона са относително консервативни, което се нарича рамков регион.Има три хиперпроменливи области във VL, обикновено разположени съответно при аминокиселинни остатъци 24 до 34 и 89 до 97.Трите HVR на VL и VH се наричат съответно HVR1, HVR2 и HVR3.Изследването и анализът на рентгенова кристална дифракция доказаха, че хиперпроменливият регион наистина е мястото, където антигенът на антитялото се свързва, така че се нарича регион, определящ комплементарността (CDR).HVR1, HVR2 и HVR3 на VL и VH могат да бъдат наречени съответно CDR1, CDR2 и CDR3.Като цяло CDR3 има по-висока степен на хипервариабилност.Хиперпроменливият регион също е основното място, където съществуват идиотипните детерминанти на Ig молекулите.В повечето случаи Н веригата играе по-важна роля при свързването с антигена.
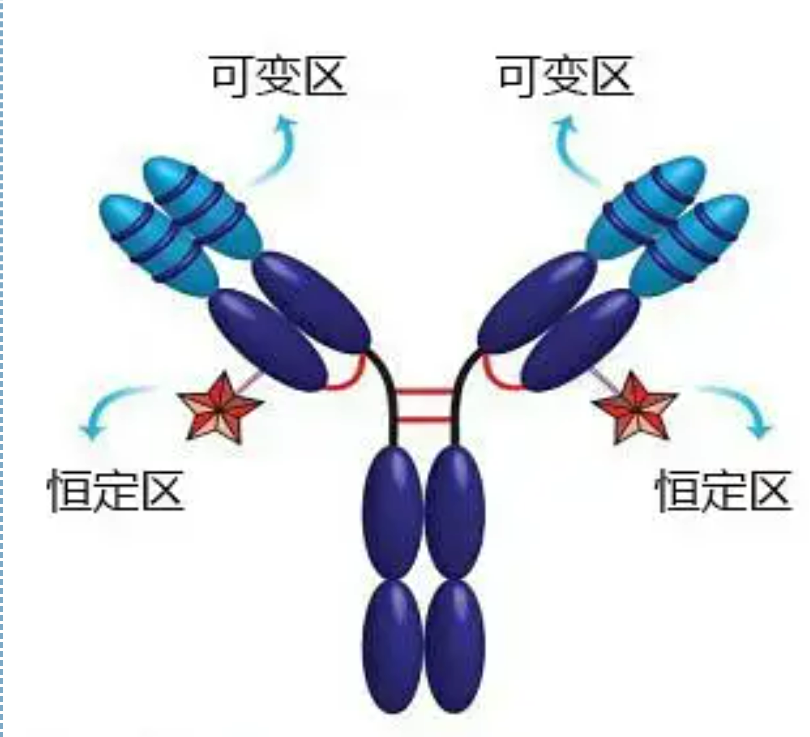 Постоянната област (C област)е разположен на 3/4 или 4/5 (приблизително от аминокиселина 119 до С терминала) на Н веригата близо до С края и 1/2 (съдържа около 105 аминокиселинни остатъка) близо до С края на L веригата.Всяка функционална област на Н веригата съдържа около 110 аминокиселинни остатъка и съдържа пептиден пръстен, съставен от 50-60 аминокиселинни остатъка, свързани с дисулфидни връзки.Аминокиселинният състав и подредбата на този регион са относително постоянни в една и съща животинска Ig изотип L верига и същия тип Н верига.Същото, той може само специфично да се свърже със съответния антиген, но структурата на неговия С регион е същата, тоест има същата антигенност.Конското анти-човешко IgG вторично антитяло (или анти-антитело) може да се комбинира с двете Получава се комбинация от антитела (IgG) срещу различни екзотоксини.Това е важна основа за приготвяне на вторични антитела и прилагане на флуоресцеин, изотопи, ензими и други белязани антитела.
Постоянната област (C област)е разположен на 3/4 или 4/5 (приблизително от аминокиселина 119 до С терминала) на Н веригата близо до С края и 1/2 (съдържа около 105 аминокиселинни остатъка) близо до С края на L веригата.Всяка функционална област на Н веригата съдържа около 110 аминокиселинни остатъка и съдържа пептиден пръстен, съставен от 50-60 аминокиселинни остатъка, свързани с дисулфидни връзки.Аминокиселинният състав и подредбата на този регион са относително постоянни в една и съща животинска Ig изотип L верига и същия тип Н верига.Същото, той може само специфично да се свърже със съответния антиген, но структурата на неговия С регион е същата, тоест има същата антигенност.Конското анти-човешко IgG вторично антитяло (или анти-антитело) може да се комбинира с двете Получава се комбинация от антитела (IgG) срещу различни екзотоксини.Това е важна основа за приготвяне на вторични антитела и прилагане на флуоресцеин, изотопи, ензими и други белязани антитела.
Свързани продукти:
Cell Direct RT-qPCR комплект
Време на публикуване: 30 септември 2021 г








